
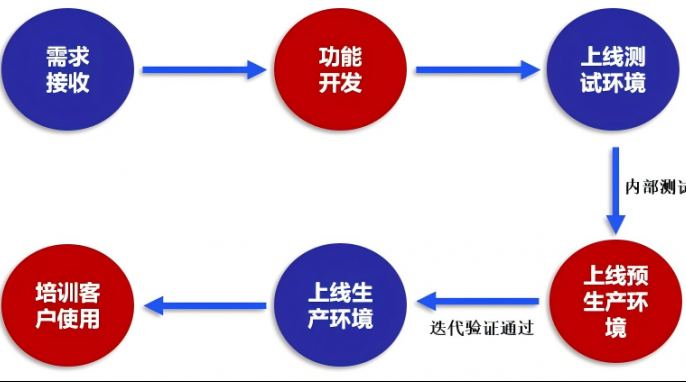
CSV已不是“可选动作”,而是法规硬性要求,更是保障数据可靠的核心!
一码到底
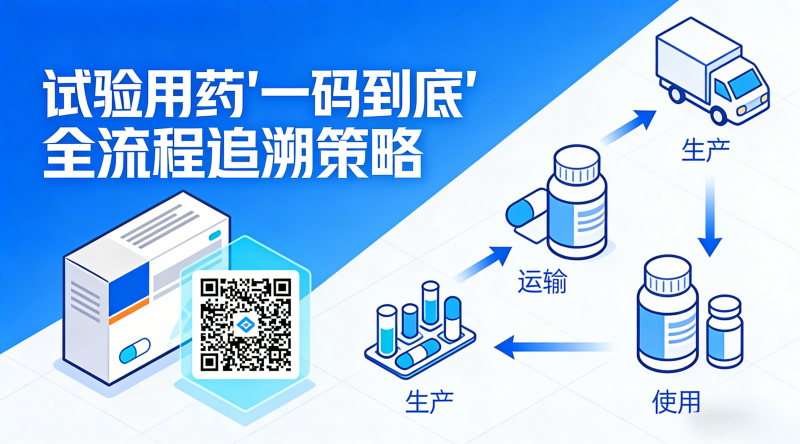
ICP平台确保每一管样品从源头到终点的轨迹都清晰、真实、可溯源。

数据从源头实现可溯源,准确、可靠。

在数字化临床试验快速发展的今天,试验参与者个人信息保护已成为各方关注的焦点。本文将结合《中华人民共和国个人信息保护法》(以下简称“《个保法》”)、《药物临床试验质量管理规范(修订稿征求意见稿)》等相关法规,为您解读临床试验中试验参与者隐私保护的要求,并分享通诺信息在系统设计中的安全实践。

近日,国家药品监督管理局药品审评中心发布了《化学仿制药生物等效性研究质量风险评估指导原则(征求意见稿)》(文章末尾详见附件),明确强调生物等效性研究质量是支撑审评决策的核心基础,要求申办方在全过程中树立质量管理理念,识别并管控风险。
为进一步提高药物Ⅰ期临床试验和生物等效性试验质量和管理水平,国家药监局核查中心组织修订了《药物Ⅰ期临床试验管理指导原则》(见附件)。经国家药品监督管理局同意,现予发布,自发布之日起施行。特此通告。附件:药物Ⅰ期临床试验管理指导原则.pdf国家药监局核查中心2025年6月20日
本法所称生物安全,是指国家有效防范和应对危险生物因子及相关因素威胁,生物技术能够稳定健康发展,人民生命健康和生态系统相对处于没有危险和不受威胁的状态,生物领域具备维护国家安全和持续发展的能力。
为推动新修订的ICH指导原则在国内的平稳落地实施,我中心组织翻译了《E6(R3):药物临床试验质量管理规范技术指导原则(GCP)》原则及附件1。现对E6(R3)原则及附件1中文翻译稿公开征求意见,为期1个月。如有修改意见,请反馈至联系人电子邮箱:gkzhqyj@cde.org.cn。相关附件:1、E6(R3)原则及附件

400-075-0875
tono@tonoinfo.com
长沙岳麓区麓谷街道文轩路1058号都正生物产业园